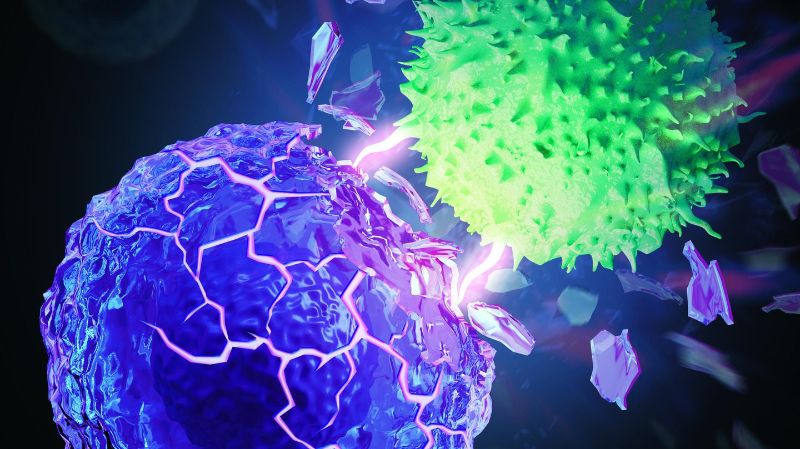
Versteifung von Krebszellen für eine bessere Immuntherapie
Die Immuntherapie ist eine vielversprechende Form der Krebsbehandlung, bei der die patienteneigenen T-Zellen angekurbelt werden, damit sie sich vermehren und Krebszellen zerstören können. Allerdings sprechen nur etwa 20 % der Krebspatientinnen auf die Immuntherapie an. Die Forschenden arbeiten hart daran, diesen Prozentsatz zu erhöhen, indem sie Methoden entwickeln, die mit der derzeitigen Immuntherapie kombiniert werden können, um die Behandlung bei mehr Krebspatienten wirksam zu machen. «Unser Ziel ist immer dasselbe – den Prozentsatz der Patientinnen und Patienten, die auf die Immuntherapie ansprechen, zu erhöhen», sagt Prof. Li Tang, Leiter des Labors für Biomaterialien für Immunoengineering an der EPFL School of Engineering. «Ein Grund für die niedrige Ansprechrate ist, dass Krebs eine sehr komplexe Krankheit ist. Wir müssen neue Ansätze erforschen, die, wie wir hoffen, auf verschiedene Aspekte der Krankheit abzielen können.»

Li Tang, Kewen Lei, and Armand Kurum © Alain Herzog / EPFL
Die Forschenden in Tangs Labor haben gerade einen solchen Ansatz entwickelt, der die Biomechanik zur Krebsbekämpfung nutzt. Ihre Methode steigerte die Wirksamkeit der Immuntherapie beträchtlich und eröffnet vielversprechende Wege für zukünftige Forschung und translationale Anwendungen. Die Studie wurde in Zusammenarbeit mit EPFL-Forschenden der Profs. Li Tang, Selman Sakar und Georg Fantner sowie einer MIT-Forschungsgruppe unter der Leitung von Prof. Ming Guo erarbeitet und soeben in Nature Biomedical Engineering veröffentlicht.
Tarnung von Krebszellen
Kewen Lei und Armand Kurum, zwei Doktoranden in Tangs Labor, kamen auf die Idee, nachdem sie beobachtet hatten, dass Krebszellen weicher sind als gesunde Zellen. Die Messung der Mechanik von Krebszellen ist eine schwierige Aufgabe, und die Zusammenarbeit mit den Labors von Sakar, Fantner und Guo trug zur Lösung dieser Herausforderung bei: «Bis heute verstehen die Forschenden diese Veränderungen nicht vollständig», sagt Lei. «Während einige Wissenschaftlerinnen glauben, dass die Weichheit von Krebszellen die Metastasierung erleichtert, wurde dies noch nicht umfassend nachgewiesen.» Die T-Zellen werden durch die Weichheit der Krebszellen getäuscht und gehen an ihnen vorbei, ohne sie anzugreifen: «Das ist eine wirklich trickreiche Form der Tarnung», sagt Kurum: «Wenn T-Zellen eine Krebszelle angreifen, drücken und ziehen sie an der Membran der Krebszelle. Wenn die Membran biegsam ist, bietet sie weniger Widerstand und ist daher für die T-Zelle schwieriger zu durchbrechen.»
Versteifung von Krebszellen mit einem Anti-Cholesterin-Medikament
Tangs Forschungsgruppe fand heraus, was die Membranen der Krebszellen weich macht: Cholesterin, ein Lipid, das natürlicherweise in Zellmembranen vorkommt. Die Wissenschaftlerinnen entwickelten einen Weg, die Cholesterinmenge in den Krebszellmembranen mit Hilfe eines gängigen Anticholesterinmittels zu verringern. Indem es die Zellmembranen steifer macht, erleichtert das Medikament den T-Zellen die Zerstörung der Krebszellen. Das Anticholesterinmedikament wurde dann mit einer Immuntherapie kombiniert.

Versteifung von Krebszellen für eine verbesserte T-Zellen-vermittelte Abtötung. © Kewen Lei / 2021 EPFL
Der nächste Schritt bestand darin, ihre neue Methode in präklinischen Modellen zu testen. Die Forschenden verabreichten die kombinierte Behandlung Mäusen mit Melanomtumoren und verglichen die Ergebnisse mit Kontrollgruppen. «Die Gruppen, die nur die Immuntherapie oder nur das Anticholesterinmittel erhielten, überlebten den Krebs nicht», sagt Tang, «aber die Hälfte der Mäuse, die die Kombinationstherapie erhielten, überlebte. Das deutet darauf hin, dass die gleichzeitige Verabreichung der beiden Behandlungen die Überlebensrate von 0 % auf 50 % erhöhen kann – eine wirklich ermutigende Entdeckung für die künftige Forschung.» Die Forschenden planen nun, ihren Ansatz mit anderen Methoden zu kombinieren, die die Leistung von T-Zellen steigern können, um die Ansprechrate der Immuntherapie bei Krebspatientinnen zu erhöhen.
Dieses multidisziplinäre Projekt wäre ohne die fruchtbare Zusammenarbeit mit den auf die Charakterisierung der Zellmechanik spezialisierten Labors der EPFL (Prof. Sakar und Prof. Fantner) und des MIT (Prof. Guo) sowie ohne die Unterstützung durch die Kerneinrichtungen der EPFL, darunter die Bioimaging and Optics Platform (BIOP), das Center of Phenogenomics (CPG) und die Flow Cytometry Core Facility (FCCF), nicht möglich gewesen.