Organoide Blasen decken Geheimnisse von Harnwegsinfektionen auf
Harnwegsinfektionen (UTIs) gehören zu den häufigsten bakteriellen Infektionen. Sie müssen in der Regel mit Antibiotika behandelt werden, und fast ein Viertel der behandelten Fälle führt zu einer wiederkehrenden Infektion. Die überwiegende Mehrheit der Harnwegsinfektionen wird durch eine Unterart des Bakteriums Escherichia coli verursacht, das Zellen infiziert, die die Blasenwand auskleiden und so genannte «intrazelluläre Bakteriengemeinschaften» bilden.

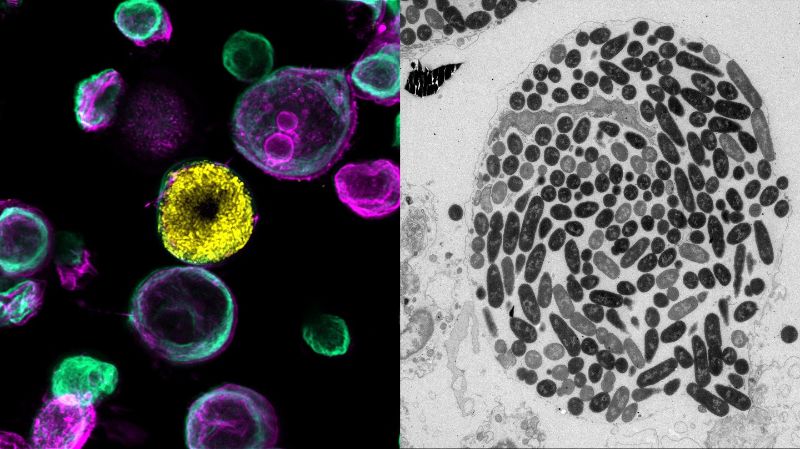
Elektronenmikroskopische Rekonstruktion der verschiedenen bakteriellen Nischen. Credit: Sharma et al.© 2021 EPFL
Die «Gemeinschaften» brechen immer wieder auf und die Bakterien dringen erneut in die benachbarten Zellen ein, wodurch die so genannten «Schirmzellen», die die äusserste Schicht des Blasenepithels auskleiden, schliesslich absterben. Durch den Verlust der Schirmzellen können die Bakterien dann in die tieferen Schichten der Blase eindringen, wo sie «ruhende intrazelluläre Reservoirs» bilden können, die gegen Antibiotika resistent sind und Rückfälle von Harnwegsinfektionen verursachen. Die Dynamik dieser Vorgänge lässt sich in vivo in Tiermodellen nur schwer erfassen.
«Die Infektionsdynamik lässt sich mit statischen Aufnahmen von Gewebeexplantaten zu verschiedenen Zeitpunkten nur schwer erfassen», sagt Kunal Sharma, der Hauptautor der beiden Studien. «Bisher haben In-vitro-Modelle die Architektur der Blase nicht mit ausreichender Genauigkeit nachgebildet, um den zeitlichen Verlauf dieser Ereignisse zu untersuchen».
Um dieses Problem zu lösen, hat die Gruppe von Professor John McKinney an der EPFL-Fakultät für Life Sciences zwei komplementäre Blasenmodelle entwickelt, um Harnwegsinfektionen kontrollierter zu untersuchen. Das erste Modell besteht aus Blasenorganoiden, die die 3D-Schichtarchitektur des Blasenepithels nachbilden. Organoide sind winzige, im Labor gezüchtete Gewebe und Organe, die anatomisch korrekt und physiologisch funktionell sind.
Das zweite Modell ist eine Blase auf einem Chip, die physiologische Stimuli enthält, z. B. die mechanische Wirkung der Blasenfüllung und -entleerung, sowie eine Schnittstelle mit dem Gefässsystem, um die Wanderung von Immunzellen zu Infektionsherden zu untersuchen. Die Fortschritte werden in den Fachzeitschriften Cell Reports und eLife. veröffentlicht.
«Durch die Erzeugung von Organoiden aus Mäusen, in deren Zellmembranen eine fluoreszierende Markierung eingearbeitet wurde, konnten wir mit Hilfe der konfokalen Live-Cell-Bildgebung der BioImaging & Optics Core Facility der EPFL spezifische bakterielle Nischen innerhalb des Organoids mit hoher räumlicher Auflösung identifizieren», sagt Sharma, «durch die Bildgebung mehrerer Organoide konnten wir Heterogenität und unterschiedliche Ergebnisse von Wirt-Pathogen-Interaktionen identifizieren. Dieses Proof-of-Concept-System hat ein vielversprechendes Potenzial für Folgestudien zur bakteriellen Persistenz gegenüber Antibiotika und zur Dynamik der Immunzellreaktionen auf Infektionen gezeigt.»
In Kombination mit der volumetrischen Elektronenmikroskopie, die von der Biological Electron Microscopy Facility der EPFL durchgeführt wurde, fanden die Forschenden heraus, dass einzelne Bakterien unabhängig von der Bildung intrazellulärer Bakteriengemeinschaften rasch in tiefere Schichten der Blase eindringen, wo sie vor Antibiotika und Immunzellen des Wirts geschützt sind. Diese Erkenntnisse könnten zur Verbesserung der Behandlungsstrategien für Harnwegsinfektionen genutzt werden.
In dem ergänzenden Bladder-on-Chip-Modell untersuchten die Forschenden die Wachstumsdynamik von Bakterien innerhalb intrazellulärer Bakteriengemeinschaften im Laufe der Zeit. Sie züchteten menschliche Regenschirm- und Endothelzellen in einem simulierten Urinflusssystem und setzten sie mechanisch unter Druck, um die natürliche Ausdehnung und Kontraktion der Blase nachzuahmen.
Diese Studie konzentrierte sich auf die Rolle der Rekrutierung von Neutrophilen als Reaktion auf eine Infektion und zeigte, dass Neutrophile intrazelluläre bakterielle Gemeinschaften nicht eliminieren können. Die Forschenden verfolgten intrazelluläre Bakteriengemeinschaften über mehrere Zyklen der Antibiotikabehandlung hinweg und stellten fest, dass sie sehr dynamisch und resistent gegen Antibiotika sind.
«Diese Studien sind Teil des vom NFS finanzierten «AntiResist»-Konsortiums, dessen Ziel es ist, realistischere In-vitro-Modelle für Infektionskrankheiten zu entwickeln und dieses Wissen zu nutzen, um optimale Behandlungsstrategien zu entwickeln, die möglicherweise einen enormen Einfluss auf die menschliche Gesundheit haben könnten», sagt McKinney.
«Mikrophysiologische Modelle schliessen die Lücke zwischen einfachen Zellkultursystemen und Tiermodellen», sagt Vivek V. Thacker, einer der Hauptautoren der beiden Studien, «die beiden Modelle ergänzen sich gut und sind auf die Untersuchung spezifischer Aspekte der Krankheit zugeschnitten. Wir hoffen, dass sie als Ressource für die breitere mikrobiologische Gemeinschaft dienen und die Synergien zwischen den Bereichen Tissue Engineering und Infektionskrankheiten fördern.»