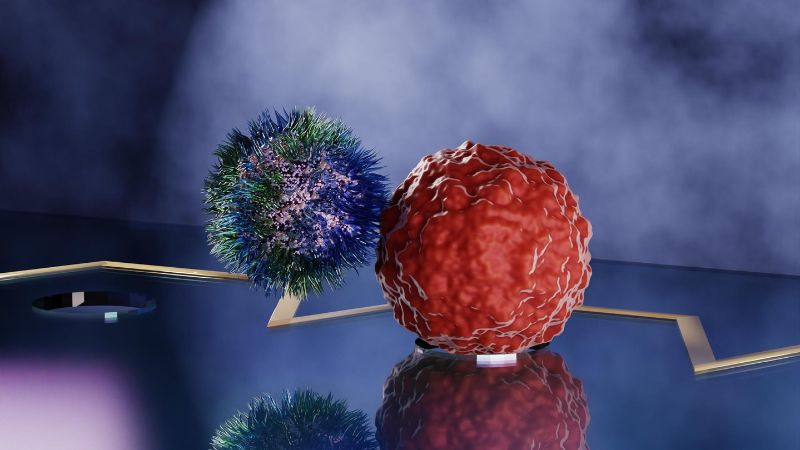
Ein Chip-Labor für das Screening und die Sortierung von T-Zellen
Derzeit ist es ein schwieriger und mühsamer Prozess, zwei Zellen miteinander in Kontakt zu bringen, um ihre Bindungseigenschaften zu untersuchen. Dies ist jedoch ein notwendiger Schritt, um zu verstehen, wie Zellen interagieren, in der Hoffnung, neue Krebsbehandlungen zu finden, insbesondere zellbasierte Krebsimmuntherapien. Die neue Technologie der EPFL-Forscherin Clémentine Lipp bringt eine wesentliche Verbesserung in diesem Bereich, indem sie zwei verschiedene Fangtechnologien in einem Chip-Labor-System kombiniert und so eine Hochdurchsatzanalyse der wesentlichen Zell-Zell-Interaktionen ermöglicht. Die Ergebnisse ihrer Arbeit wurden in der Zeitschrift Lab On A Chip veröffentlicht und von der Zeitschrift als «heisser Artikel für 2023» ausgewählt.
«Wenn ich erzähle, was ich mache, ist es am einfachsten zu erklären, dass ich eine Speed-Dating-Umgebung für Zellen schaffe», sagt Lipp. Und auch wenn das wie ein halber Scherz klingen mag, ist die Analogie sehr treffend. Das Verständnis der Interaktion zwischen Zellen ist für viele wissenschaftliche Bemühungen von entscheidender Bedeutung, und die Beschleunigung dieses Prozesses wird wahrscheinlich ganze Studienbereiche beschleunigen.
Speziell in der Zelltherapie suchen Krebsforschende nach T-Zellen, die auf Tumorzellen reagieren und diese zerstören können. Damit eine T-Zelle eine Reaktion des Immunsystems auslösen kann, muss sie sich über ihren spezialisierten Rezeptor an die Tumorzelle anheften, ein Parameter, der als Adhäsionszustand bekannt ist. Bisher mussten einzelne Zellen oder Zellpopulationen manuell in einer schwer zu manipulierenden mikroskopischen Umgebung miteinander in Kontakt gebracht werden. Das neue mikrofluidische Gerät hingegen ermöglicht die unabhängige Kontrolle dieser beiden Zelltypen und hat das Potenzial, das Zellscreening für T-Zellen und andere Anwendungen zu revolutionieren.
In einem mikrofluidischen Gerät, das auch als Lab-on-a-Chip bezeichnet wird, werden Zellen in ein Labyrinth mikroskopisch kleiner Kanäle eingebracht und mit Hilfe der Flüssigkeitsströmung durch die Bahnen getrieben. Diese Miniaturlaboratorien, die erstmals in den 1980er Jahren auftauchten, bieten viele Vorteile gegenüber herkömmlichen Methoden: Sie sind schneller, kleiner, anpassbar, präziser und ermöglichen eine Automatisierung. Um die Interaktion von Zellen mit Flüssigkeiten und anderen Zellen zu untersuchen, muss die Zelle oder müssen die Zellen an einem bestimmten Ort festgehalten werden. Für ein T-Zell-Screening in einem solchen Gerät müssten die Forschenden sowohl die T-Zelle als auch die Tumorzelle einfangen, ohne die Zelle zu beschädigen – ein Kunststück, das bisher nicht möglich war und das T-Zell-Screening bisher von den Vorteilen der Lab-on-a-Chip-Technologie ausgeschlossen hat.
Das Neue an Lipps Gerät ist, dass es das T-Zell-Screening in die Welt der Mikrofluidik bringt, indem es zwei Fallenmethoden kombiniert: eine, die auf dem planaren hydrodynamischen Einfangen von Zellen basiert, und eine andere, die auf dielektrophoretischem (DEP) Einfangen beruht. Diese hydrodynamischen Fallen beruhen auf mikroskopisch kleinen Löchern, die die Zelle durch Druckveränderungen in der flüssigen Umgebung einfangen – man stelle sich vor, man würde einen Baseball mit einem Vakuumschlauch sanft ansaugen, um ihn an Ort und Stelle zu halten, nur eben tausendmal kleiner. Beim DEP-Trapping hingegen handelt es sich um eine völlig andere Technologie, bei der die Polarität einer Zelle ausgenutzt wird, um sie durch Ein- und Ausschalten von Elektroden elektrisch einzufangen. Beide Einfangtechniken erfordern Mikrofertigung und sind beeindruckende Beispiele für Präzisionsmikrotechnik.
Die Kombination dieser beiden unterschiedlichen Fängersysteme ermöglicht die unabhängige Manipulation von Zellen in der mikrofluidischen Vorrichtung und bietet eine räumliche und zeitliche Kontrolle über ihren Kontakt. Infolgedessen können auf dem Chip verschiedene Adhäsionsuntersuchungen durchgeführt werden, was ihn zu einem vielseitigen Instrument für verschiedene immunologische Studien macht. Der neue Mikrofluidik-Chip ist so konzipiert, dass die Integrität der Zellen und die Rezeptorfunktionen erhalten bleiben, was den Weg für die Entwicklung von Geräten mit grösserem Durchsatz durch Automatisierung ebnet. Die Kombination dieser Technologie mit der Automatisierung sollte zu einem schnelleren und kostengünstigeren Screening und Sortieren von T-Zellen führen, wodurch zellbasierte Immuntherapien leichter zugänglich und breiter einsetzbar werden.