Entscheidende Unterschiede im Innenleben von Immunzellen aufgedeckt
In Kürze
- Die sogenannten zytotoxischen T-Zellen sind ein wichtiger Bestandteil des Immunsystems. Sie lassen sich in kurzlebige Effektorzellen und in langlebige Gedächtniszellen aufteilen.
- Mit ihren Untersuchungen haben Forschende an der ETH Zürich gezeigt, dass die Innenarchitektur der T-Zellen beeinflusst, welche der beiden Funktionen sie annehmen, wenn sie einem Erreger begegnen und dadurch aktiviert werden.
- Die Ergebnisse vertiefen nicht nur unser Verständnis des Immunsystems, sondern sie haben auch das Potential, zu verbesserten Krebstherapien beizutragen.
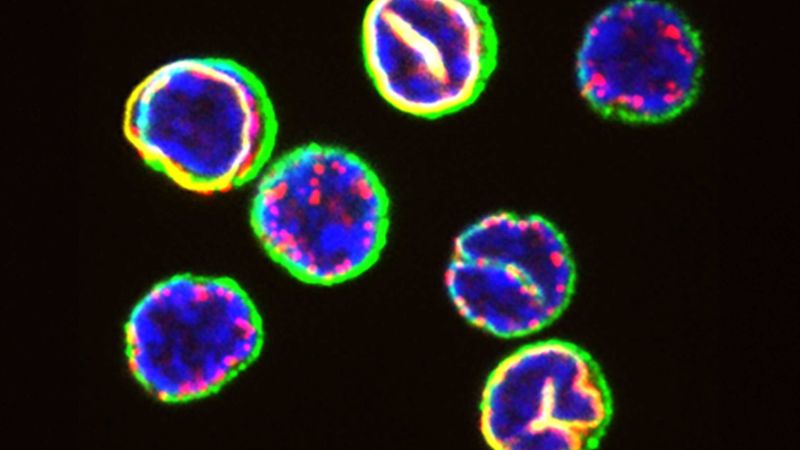
Von aussen sehen die meisten Immunzellen genau gleich aus: klein und kugelrund. Doch nun haben Forschende um Berend Snijder vom Institut für Molekulare Systembiologie an der ETH Zürich mit ausgefeilten Methoden einen Blick in ihr Inneres geworfen. Und dabei entdeckt, dass der Aufbau – «die Zellarchitektur» in Snijders Worten – von sogenannten zytotoxischen T-Zellen über ihr Schicksal entscheidet.
Merkmale, die das Schicksal bestimmen
Wenn sie einem Erreger begegnen, entwickeln sich Zellen mit Einstülpungen im Zellkern zu wirkmächtigen Effektorzellen, die sich rasch vermehren und den Erreger abtöten. Ihre Schwesterzellen mit einem kugeligen Zellkern hingegen sind gemächlicher unterwegs: Ihre Aktivierung nimmt mehr Zeit in Anspruch – und führt schliesslich zur Bildung von langlebigen Gedächtniszellen, die den Organismus vor einem erneuten Befall mit dem gleichen Erreger schützen.
Dass es diese zwei T-Zellpopulationen mit unterschiedlichen Funktionen gibt, weiss die Wissenschaft seit etwa 50 Jahren. «Bis anhin war jedoch nicht klar, welche Merkmale eine T-Zelle aufweisen muss, um sich nach ihrer Aktivierung in eine Effektor- oder in eine Gedächtniszelle zu entwickeln», sagt Ben Hale, Postdoktorand in Snijders Forschungsgruppe und Erstautor des soeben in der Fachzeitschrift Science erschienenen Beitrags.
Um nach diesen Merkmalen Ausschau zu halten, haben die Forschenden eine Plattform erstellt, die Mikroskopiebilder von Immunzellen automatisch auswerten kann. Dieser Plattform haben die Forschenden Tausende von T-Zellen von 24 gesunden Personen vorgesetzt, die ihr Blut freiwillig dem Zürcher Blutspendedienst des Schweizerischen Roten Kreuzes gespendet hatten.
Unerwartete Unterschiede
Mit einer auf maschinellem Lernen beruhenden Methodik klassifizierte die Plattform die Zellen in drei unterschiedliche Gruppen. «Wir hatten zuvor schon gesehen, dass einige T-Zellen nach ihrer Aktivierung flaschenförmig sind», sagt Snijder. «Aber dass sich auch die runden Zellen in zwei verschiedene Gruppen aufteilen lassen, hatten wir nicht erwartet.»
In weiteren Untersuchungen stellten die Forschenden ausserdem fest, dass die Unterschiede in der Zellarchitektur der runden Zellen eine funktionelle Bedeutung haben. «Die Zellen mit Einstülpungen des Zellkerns sind auf eine rasche Aktivierung ausgerichtet: Innerhalb von 24 Stunden verwandeln sich viele von ihnen in die flaschenförmigen Effektorzellen», sagt Hale.
«Zudem reagieren sie stärker, wenn sie aktiviert werden. Und sie vermehren sich viel rascher als Zellen ohne Einstülpungen», ergänzt Snijder. Mit seinem Team hat er auch den molekularen Mechanismus der rascheren und stärkeren Aktivierung der Zellen mit Einstülpungen aufgeschlüsselt: «Dank der speziellen Zellarchitektur können viel mehr Kalzium-Ionen einströmen», sagt Snijder.
Im Gespräch mit den beiden Forschenden wird klar, dass noch zahlreiche Fragen einer Antwort harren. Zum Beispiel will Snijder mit seinem Team herausfinden, wie der Organismus sicherstellt, dass immer etwa 60 Prozent der zytotoxischen T-Zellen im Blut Einstülpungen aufweisen, während bei 35 Prozent keine Einstülpungen auszumachen sind und die restlichen 5 Prozent flaschenförmig daherkommen.
Klinische Wirksamkeit von Behandlungen verbessern
Ihre Resultate seien nicht nur «für das grundlegende Verständnis der Funktionsweise unserer Immunzellen wichtig», meinen Snijder und Hale, sondern spielten zum Beispiel auch im Kampf gegen Krebs eine wichtige Rolle: «Viele neuartige Behandlungen setzen T-Zellen ein, um die Krebszellen abzutöten», sagt Snijder. «Wenn wir in Zukunft gezielt diese zelluläre Architektur auswählen und einsetzen können, die sich stärker aktivieren lassen, können wir vielleicht die klinische Wirksamkeit solcher Behandlungen verbessern.»