Bakterien fressen Bakterien auf
Auch Winzlinge können brutal sein – und potenzielle Nahrungskonkurrenten nicht nur aus dem Weg räumen, sondern die abgetöteten Nachbarn als Nahrungsquelle nutzen. Zu diesem Schluss gelangt die Forschungsgruppe um Olga Schubert und Martin Ackermann am Wasserforschungsinstitut Eawag. Die Forschenden haben mit dem Team um Cara Magnabosco an der ETH Zürich und anderen Forschungsgruppen zusammengearbeitet und ihre Ergebnisse soeben in der Fachzeitschrift Science veröffentlicht.
Speer mit einer giftbeladenen Spitze
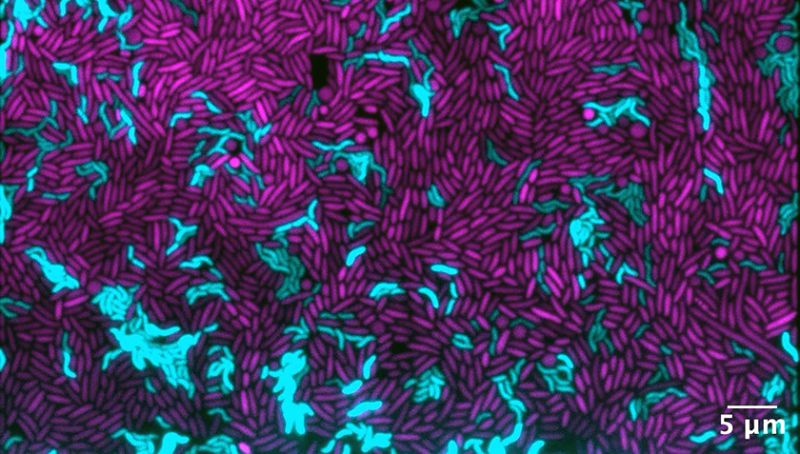
Auf das ruchlose Verhalten der Bakterien aufmerksam geworden sind die Forschenden, als sie zwei verschiedene Arten von im Meer lebenden, stäbchenförmigen Bakterien in winzigen Wachstumskammern unter dem Mikroskop beobachteten. «Uns fiel auf, dass Zellen der einen Art begannen, sich aufzulösen, wenn sie mit Zellen der anderen Art in Kontakt kamen», sagt Astrid Stubbusch, die Erstautorin der Studie.
Beide Arten gehören zur selben Gattung der sogenannten Vibrio-Bakterien. Sie unterscheiden sich unter anderem dadurch, dass die eine Art einen Komplex aus 14 verschiedenen Proteinen herstellt. Im Fachjargon wird dieser Komplex als «Typ-6-Sekretions-System», kurz T6SS, bezeichnet. Der Fachname besagt zwar, dass Bakterien über mehrere solcher Systeme verfügen. Doch er verrät mit keiner Silbe, dass diese Systeme hochkomplexe Waffen in einem Krieg sind, den Bakterien untereinander ausfechten.
Martin Ackermann stellt sich das T6SS als Speer mit einer giftbeladenen Spitze vor vor. Die räuberischen Bakterien schiessen den Speer ab. Er dringt in die Nachbarzelle ein, fügt ihr aber dadurch keine tödlichen Verletzungen zu. «Erst das Gift, das der Speer in die Nachbarzelle bringt, tötet die Zelle», sagt Ackermann. Denn: «Die Killerzellen selber sind immun gegen das Gift. Zellen der gleichen Art schiessen sich dauernd gegenseitig ab, ohne sich umzubringen.»
Zuerst kugelrund, danach weg
Die Beutezellen hingegen gehören zu Bakterienarten, die weder einen Speer noch die für das Unschädlichmachen des Gifts benötigten Proteine herstellen können. Wenn sie angegriffen werden, sterben sie. Unter dem Mikroskop beobachteten die Forschenden, dass die Beutezellen dabei nicht platzten, sondern zuerst kugelrund wurden – und sich danach langsam auflösten.
Die Dauer, bis sie sich auflösten, hing davon ab, welche Flüssigkeit die Forschenden durch die winzigen Wachstumskammern strömen liessen. Eine Flüssigkeit enthielt Alginat: Das ist eine häufige Kohlenstoffverbindung im Meer. Sie kann allerdings nur von den Beutezellen abgebaut werden und ihnen damit als Nahrung dienen, nicht aber von den Killerzellen. Die andere Flüssigkeit enthielt eine kohlenstoffhaltige Verbindung, die von beiden Arten verstoffwechselt werden kann.
In der Flüssigkeit mit der Nahrung für Killer- und Beutezellen waren die kugelrunden Zellen nach knapp 20 Minuten weg, in der Flüssigkeit mit Alginat erst nach rund 86 Minuten. Mit Modellrechnungen haben die Forschenden errechnet, dass «der ungefähre Gesamtnährstoffgewinn von T6SS-positiven Zellen bei der langsamen Auflösung ihrer Beutezellen etwa 2 bis 50 Mal höher ist als bei der schnellen Auflösung», schreiben die Forschenden in ihrem Fachbeitrag.
Wie Fuchs und Hase
«Dieser Unterschied in der Auflösungsdauer könnte bedeuten, dass die Killerzellen ihre Speere mit verschiedenen Giften beladen», sagt Glen D’Souza, einer der Autoren der Studie. Wenn die Killerzellen in ihrem Umfeld gelöste Nahrung vorfinden, töten sie die Beutezellen rasch ab. Und stellen dadurch sicher, dass ihnen die Beutezellen nicht die in der Umgebung enthaltene Nahrung streitig machen.
Wenn die Killerzellen jedoch sonst nichts essen können, haben sie ein grosses Interesse daran, sich die organischen Moleküle, die im Zellsaft der Beutezellen enthalten sind, nicht entgehen zu lassen. «Also sorgen sie dafür, dass sich die Beutezelle in der Nachbarschaft schön langsam entleert, damit sie möglichst viele Nährstoffe aufnehmen können», sagt D’Souza.
In der Flüssigkeit mit Alginat können die Killerzellen nicht von selbst wachsen, sie sind auf die Beutezellen angewiesen. Martin Ackermann hat auch hier wieder ein eingängiges Bild zur Hand: Er vergleicht das Alginat mit Gras auf einer Wiese, die Beutezellen mit einem Hasen, die räuberischen Zellen mit einem Fuchs. «Der Fuchs hat keine Angst, dass ihm der Hase das Gras wegfrisst, er kann es sowieso nicht essen», sagt Ackermann. «Der Fuchs jagt einfach seine Beute.»
Den T6SS-Komplex kennt die Fachwelt schon seit längerer Zeit. Bisher ging sie davon aus, dass er dazu dient, Nahrungskonkurrenten auszuschalten. «Wir haben gezeigt, dass das nicht seine einzige Funktion ist», sagt Ackermann. «Die räuberischen Zellen verwenden ihn auch, um ihre Beute erlegen und auffressen zu können.»
Genetisch auf räuberisches Leben getrimmt
Um herauszufinden, wie verbreitet dieses neu entdeckte bakterielle Verhalten ist und welche ökologische Relevanz es haben könnte, hat das das Team riesige Datenbanken durchforstet, in denen die DNA-Sequenzen von winzigen Lebewesen wie Bakterien, Pilzen und Viren gespeichert sind, die der Wissenschaft bei der Beprobung verschiedenster Lebensräume ins Netz gegangen sind.
Am Schluss dieser Analysen stand zweierlei fest. Erstens: Den Bakterienarten, die über die T6SS-Gene verfügen, fehlen dafür oft Gene für die Verstoffwechselung von komplexen Substanzen (wie etwa das Alginat). In anderen Worten: Viele Killerzellen sind genetisch auf räuberisches Leben getrimmt. Und haben sich im Laufe der Evolution also auf das Fressen von Nachbarzellen spezialisiert.
Zweitens zeigten die genetischen Untersuchungen der Forschenden, dass das «T6SS praktisch überall zu finden» ist, sagt Ackermann. Den grössten Anteil an T6SS-positiven Bakterien – knapp 40 Prozent – fanden die Forschenden in der sogenannten Rhizosphäre, also dem Raum rund um die Pflanzenwurzeln im Boden, wo sehr enge Zellkontakte zwischen vielen verschiedenen Mikroben an der Tagesordnung sind.
Mögliche Auswirkungen auf die Kohlenstoffpumpe im Meer
In den Ozeanen machen die Killerzellen nur rund 4 bis 7 Prozent aller Bakterienarten aus. Doch die Forschenden vermuten, dass sie gerade dort bei der sogenannten Kohlenstoffpumpe im Meer eine Rolle spielen und dadurch sogar das globale Klima beeinflussen könnten.
Die Kohlenstoffpumpe gründet auf dem Umstand, dass sich das Leben im Meer grossmehrheitlich in den obersten Wasserschichten abspielt. An der Oberfläche fangen mikroskopisch kleine Algen das Sonnenlicht ein. Sie wachsen und vermehren sich – und entnehmen dabei der Atmosphäre Kohlenstoffdioxid (CO2). Den Kohlenstoff brauchen sie für den Aufbau ihrer Biomasse.
Die Algen sind das Futter des sogenannten Zooplanktons. Das sind viele verschiedene, winzige Wesen, die in den obersten Wasserschichten herumschwimmen, solange sie leben. Dann als Kadaver sinken sie – vermischt mit toten Algen und den Exkrementen des noch lebenden Zooplanktons über ihnen – langsam und sachte als Flocken des sogenannten Meeresschnees in die tieferen Schichten hinab.
Die meisten Flocken werden auf dieser Reise in die Tiefe von Bakterien abgebaut. Dadurch gelangt der Kohlenstoff wieder an die Oberfläche. Doch einige Flocken sinken bis zum Grund der Ozeane hinab, wo sie während Tausenden von Jahren bleiben. Insgesamt versenkt die Kohlenstoffpumpe jedes Jahr etwas mehr als zehn Gigatonnen Kohlenstoffdioxid, das entspricht etwa einem Viertel des weltweiten jährlichen Ausstosses.
Wie die Killerzellen mit ihrem räuberischen Verhalten die Kohlenstoffpumpe beeinflussen, ist noch unklar. Im Gespräch führen die Forschenden mehrere mögliche Mechanismen auf, die die Pumpe beschleunigen oder im Gegenteil abbremsen. «Auf jeden Fall ist es faszinierend, dass Beziehungen zwischen mikroskopisch kleinen Bakterienzellen sich auf den globalen Kohlenstoffzyklus auswirken könnten», sagt Schubert.