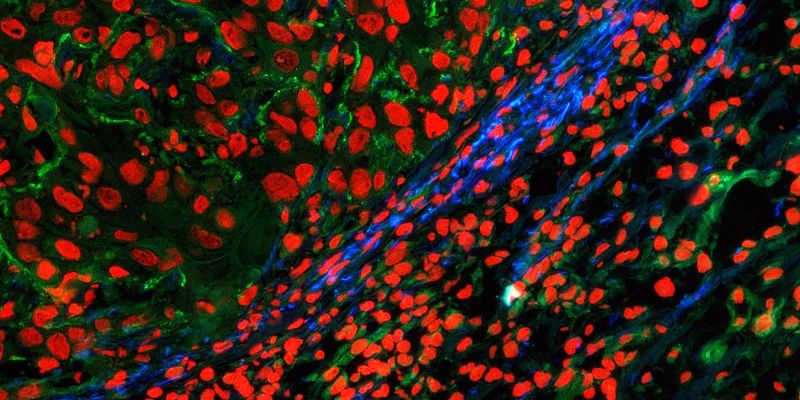
Leuchtfeuer bei Gewebebildung
Die häufigsten Proteine in unserem Körper sind Kollagene. Sie machen rund ein Drittel aller Proteine aus und vernetzen sich zu stabilen Fasern. Haut, Sehnen, Knorpel, Knochen und Bindegewebe bestehen daraus. Forschende der ETH Zürich haben nun ein aus mehreren Komponenten bestehendes Molekül entwickelt, das mit Kollagen wechselwirkt und mit dem sichtbar gemacht werden kann, wo sich im Körper Gewebe neu bildet.
Zu einer verstärkten Neubildung von Kollagenfasern kommt es zum Beispiel während der Wundheilung, aber auch beim Wachstum von Tumoren. Im Rahmen dieser Neubildung vernetzen sich die fadenförmigen Kollagenmoleküle zu den stabilen Fasern. Dazu ist ein Enzym namens LOX nötig. Es oxidiert bestimmte Stellen in den Kollagenmolekülen. Diese chemisch veränderten Stellen reagieren anschliessend mit ihresgleichen auf anderen Kollagensträngen und verbinden sich mit diesen.
Sensor und funktionelles Peptid
Die Forschenden unter der Leitung von Helma Wennemers, Professorin am Laboratorium für Organische Chemie der ETH Zürich, entwickelten ein Sensormolekül mit induzierbarer Fluoreszenz. Es fluoresziert an sich nicht. Erst nachdem es mit dem Enzym LOX reagiert hat, beginnt es zu fluoreszieren. Das Sensormolekül ist also ein Marker für LOX-Aktivität. Dieses Molekül verknüpften die Wissenschaftler anschliessend mit einem kurzen fadenförmigen Peptid, welches Kollagen ähnlich ist. Die Forschenden haben dieses Peptid mit einer sogenannten reaktiven Gruppe ausgestattet, die ausschliesslich mit oxidiertem Kollagen reagiert.
In Zusammenarbeit mit Forschenden der Gruppe von Sabine Werner, Professorin für Zellbiologie, führten die Wissenschaftler Versuche an Mäusen durch, denen sie das Mehrkomponenten-Molekül in die Haut injizierten, sowie In-vitro-Experimente mit Gewebeschnitten. Damit konnten sie zeigen: Das Molekül lagert sich dort in Kollagenfasern ein, wo sich gerade neues Gewebe bildet. Und es fluoresziert dann, wenn die Gewebeneubildung in Gang gebracht und dabei das Enzym LOX gebildet wird. «Durch den modularen Aufbau und die drei Komponenten – Sensor, Peptid und reaktive Gruppe – ist unser System ausgesprochen spezifisch und präzise», sagt Matthew Aronoff. Er ist Senior Scientist in Wennemers Gruppe und Erstautor der Studie.
Für die Krebsmedizin und Wundheilung
Weil beim Wachstum von Tumoren neues Gewebe vor allem an den Tumorrändern gebildet wird, kann das neue Molekül dazu verwendet werden, um etwa bei Untersuchungen von Biopsien die Ränder des Tumors sichtbar zu machen. «Eine unserer Visionen ist, dass Chirurginnen und Chirurgen dieses Molekül dereinst direkt auf dem Operationstisch während der Entfernung eines Tumors verwenden können», sagt ETH-Professorin Wennemers. Das Molekül würde den Chirurgen den Tumorrand anzeigen und helfen, den ganzen Tumor zu entfernen.
Weitere mögliche Anwendungen des neuen Marker-Moleküls betreffen die Wundheilung, etwa die Erforschung der Gewebebildung grundsätzlich oder von Heilungsstörungen bei Diabetes und anderen Krankheiten. Entsprechende Fragestellungen sollen auch im Rahmen des interdisziplinären Hautforschungsprojekts Skintegrity, an dem die ETH Zürich beteiligt ist, untersucht werden.
Die Wissenschaftler haben für das System ein Patent eingereicht. Derzeit loten sie verschiedene Möglichkeiten aus, wie es zur Marktreife gebracht beziehungsweise für zusätzliche Anwendungen weiterentwickelt werden kann.
Für diese Forschungsarbeit, die nun erstmals in einer Fachzeitschrift veröffentlicht wurde, wurden die Forschenden im vergangenen Jahr mit dem Spark-Award der ETH Zürich ausgezeichnet. Weitere Informationen in diesem Video (auf Englisch):